
Übersetzungen für alle Arzneimittelzulassungen, inkl. PL und SmPC
Professionell in alle 24 EU-Sprachen bzw. 26 EWR-(EEA-)Sprachen
Die Zulassung von Arzneimitteln ist in Europa strikt reguliert und erfordert in der Regel umfangreiche Fachübersetzungen medizinischer und pharmakologischer Dokumente.
Als spezialisierter Sprachdienstleister hat mpü erstklassige Lösungen für alle Arzneimittel erarbeitet, die sowohl auf internationale Zulassungen zugeschnitten als auch an nationale Regularien angepasst sind.
- Alle Arzneimittel
einschließlich aller Spezialgebiete, z.B.:- Pädiatrische Arzneimittel
- Onkologische Arzneimittel
- Orphan Drugs
- Tierarzneimittel
- etc.
- Generika
- Biosimilars
Arzneimittelzulassungen erfordern Präzision – wir liefern sie. Erfahren Sie mehr über unsere maßgeschneiderten Übersetzungsleistungen.
Über 45 Jahre Übersetzungserfahrung für Ihre sichere
Arzneimittelzulassung
Aufgrund der langjährigen Erfahrung und Expertise ist mpü bestens vertraut mit den branchenspezifischen Herausforderungen der Pharma- und Biotechnologie-Industrie.
Mit unserem umfassenden interdisziplinären Leistungsspektrum verfügen wir speziell für Übersetzungen im Rahmen aller Zulassungsverfahren über validierte Prozesse, die allen europäischen sowie nationalen Regularien entsprechen und Behördenakzeptanz sichern:
- Zeitmanagement mit kurzen Lieferfristen
- Sicherheit durch ständige Weiterentwicklung erprobter und bewährter Verfahren
- Durchgängig konsistente Qualität
- Qualitätssicherung durch Übersetzungsvariante nach DIN EN ISO 17100
- Operative Exzellenz für mehr Effizienz und Effektivität
Wir beherrschen 150 Sprachen
Regulatory Labeling – Linguistische Expertise in allen Phasen des Life Cycle
mpü bietet Ihnen ein Komplettpaket aus Lösungen und Leistungen für die Zulassung von Arzneimitteln unter strenger Einhaltung aller Regularien/Vorschriften der Europäischen Arzneimittel-Agentur (EMA) sowie anderer länderspezifischer Behörden.
- Erstellung der englischen Produktinformation (SmPC, PIL, Labeling), auch bekannt als:
- Fachinformation, Zusammenfassung der Merkmale des Arzneimittels, Summary of Product Characteristics (SmPC),
- Packungsbeilage, Gebrauchsinformation, Package Information Leaflet (PIL), Package Leaflet,
- Etikettierung, Etikett(en), Labeling, Text on Inner- and Outer Packaging
- Übersetzung in 26 QC-geprüfte Sprachversionen
- Qualitätssicherung
- Readability User Test
- Linguistic Review
Lassen Sie Ihre Arzneimittelzulassung nicht an linguistischen Hürden scheitern. Wir unterstützen Sie mit erstklassigen Übersetzungen.
Übersetzungen im Rahmen von Arzneimittelzulassungen: Vorausschauende Planung – Flexibles Zeitmanagement
mpü garantiert Ihnen sorgfältige vorausschauende Planung des gesamten Übersetzungsprozesses und zeitgerechte Lieferung korrekter und geprüfter nationalsprachlicher Dokumente zur sicheren Einhaltung der Einreichungsfristen.
Timelines des Übersetzungsprozesses der Zulassungsverfahren
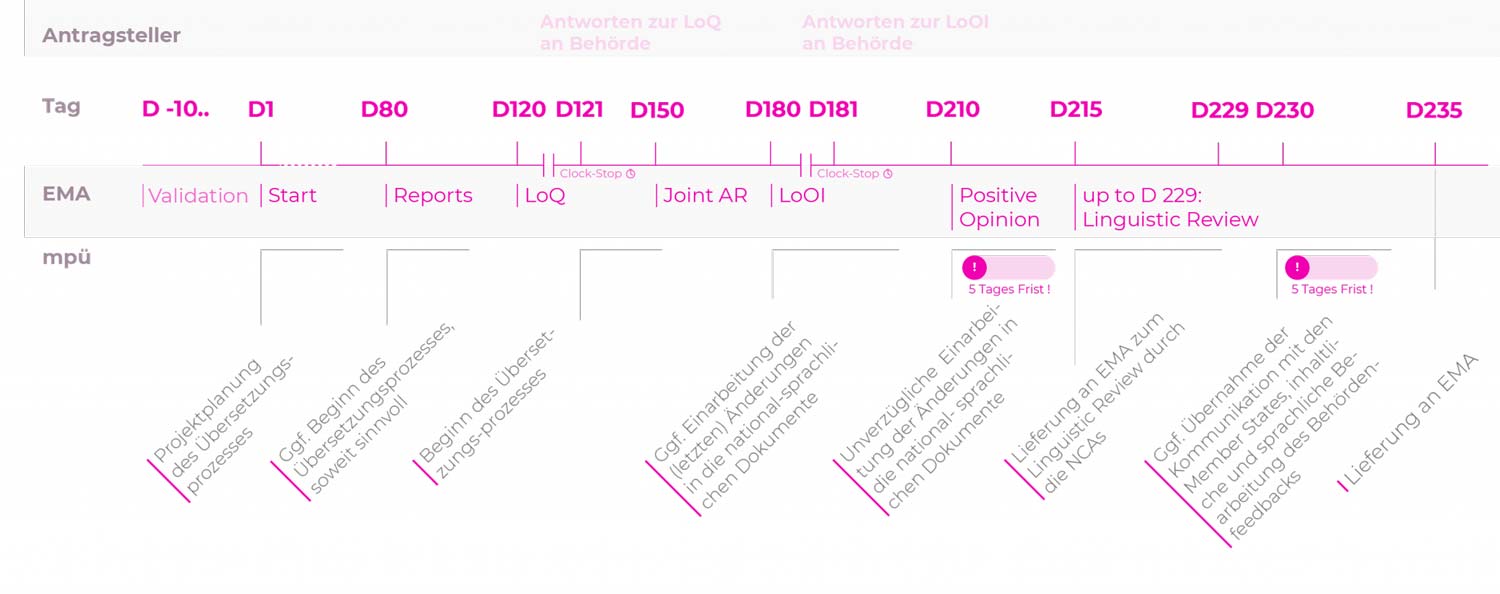
Zentrales Zulassungsverfahren (CP): Normales Verfahren
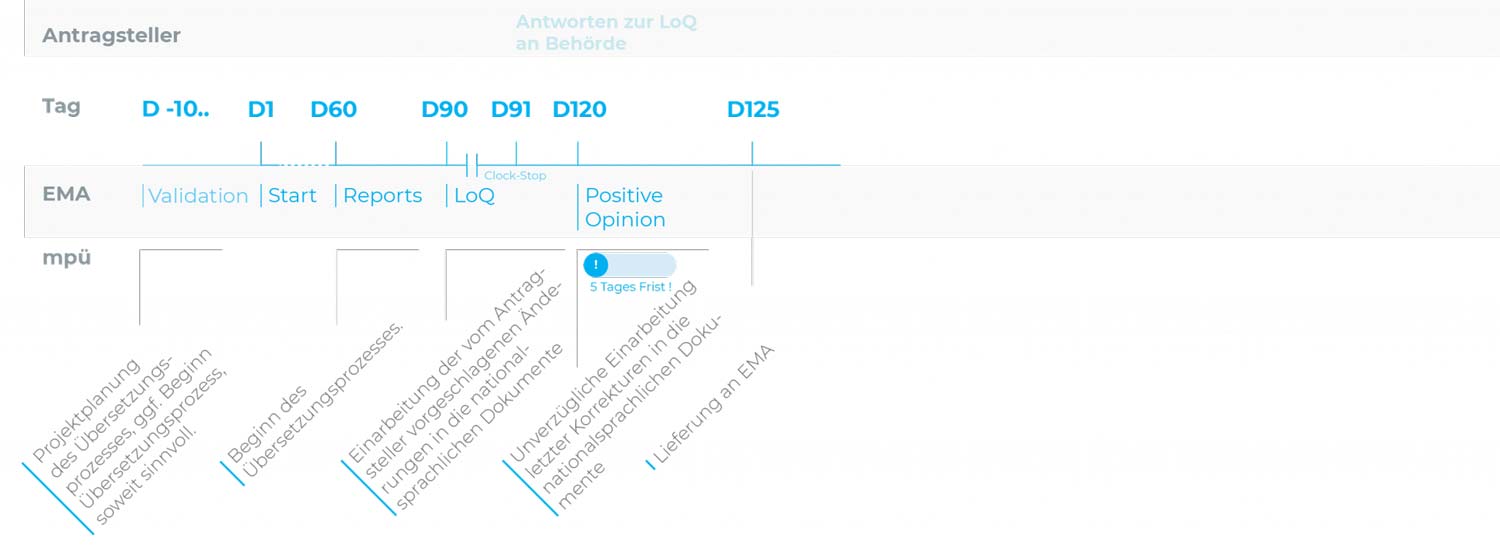
Zentrales Zulassungsverfahren (CP): Verkürztes Verfahren
Wir sind Ihr linguistischer Partner für die globale Arzneimittelzulassung. Vertrauen Sie auf unsere Expertise für Ihren internationalen Erfolg.
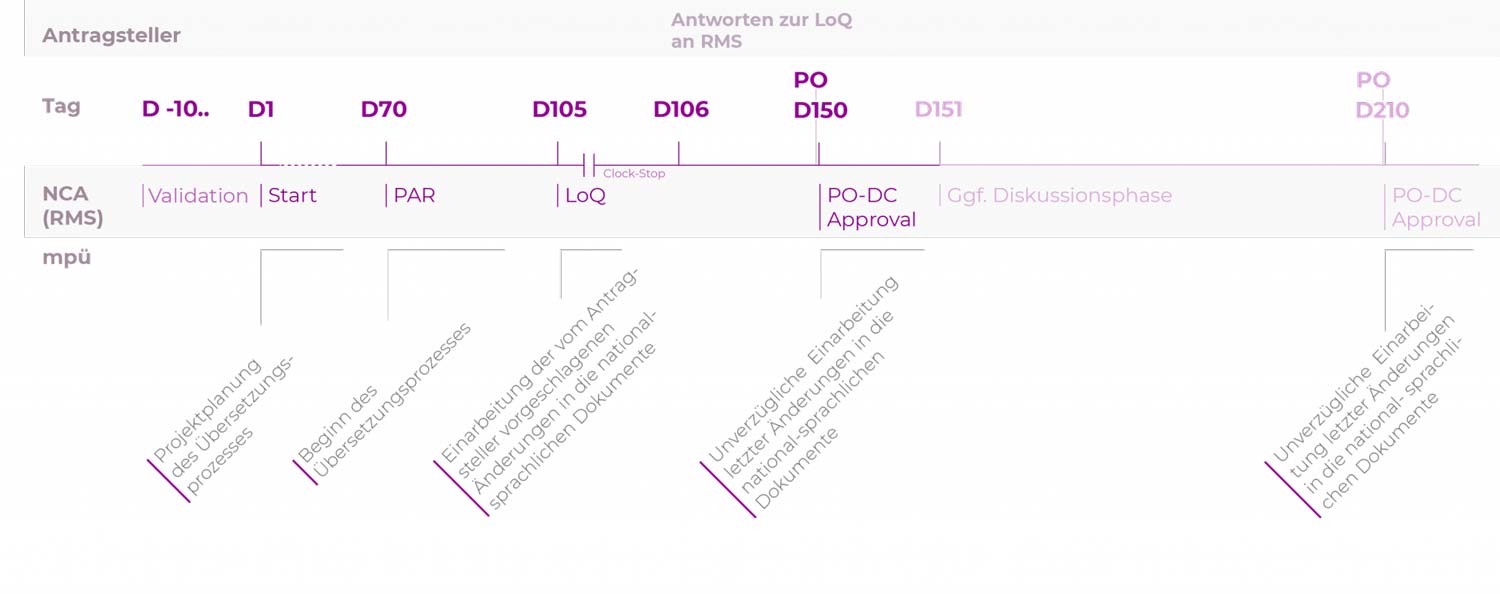
Dezentrales Zulassungsverfahren (DCP)
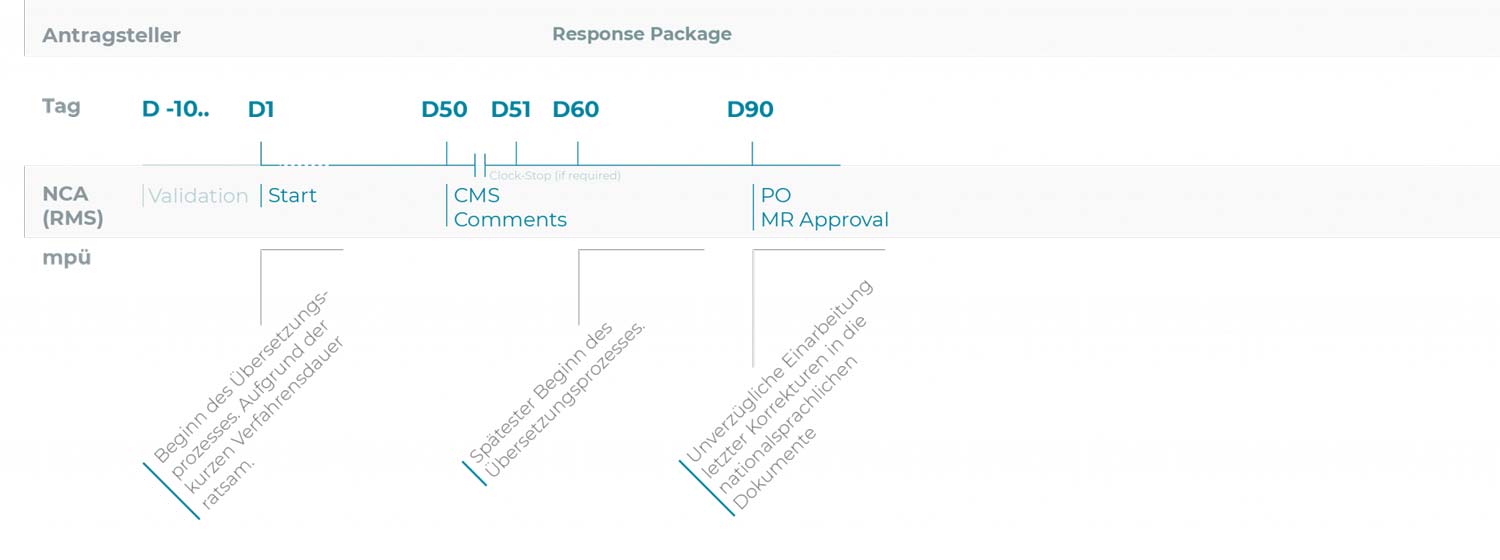
Verfahren gegenseitiger Anerkennung (MRP)
Immer pünktlich und jederzeit für Sie bereit
Einhaltung kurzer Zulassungsfristen
Um bei der Einreichung aller landessprachlichen Dokumente nach der „Positive Opinion“ (CP) bzw. nach dem „Approval“ (MRP/DCP) ein Versäumnis der Einreichungsfristen zu vermeiden, empfiehlt es sich, den Übersetzungsprozess der Quelltexte bzw. der Übertragung geänderter Textteile in die landessprachlichen Dokumente frühestmöglich zu beginnen,
d.h. optimalerweise ab dem Tag der Einreichung des Zulassungsantrages bzw. des Variation-Antrages/der Variation Notification.
Gemeinsam bringen wir Ihre Arzneimittel sicher und termingerecht auf den globalen Markt. Lassen Sie uns zusammenarbeiten.
Die 5-Tages-Frist nach Positive Opinion (CP) bzw. nach Approval (DCP/MRP) sollte letzten Änderungen vorbehalten sein.
Wochenendarbeit: kein Problem bei mpü.
Beim zentralen Zulassungsverfahren (CP) sind wir nach der Positive Opinion für die 5‑Tages‑Frist auch übers Wochenende für Sie im Einsatz, um alle Sprachversionen rechtzeitig zu finalisieren.
Anpassungen an die aktuellen QRD-Template-Versionen und Reviews/Lektorate bestehender Übersetzungen können schon vor Abschluss der Antragsprüfung bzw. vor Eingang der „Positive Opinion“ (CP) bzw. des „Approval“ (DCP/MRP) vorbereitend erfolgen.
Unsere schnelle Reaktionszeit sichert Ihre Deadline
Übersetzung aller Produktinformationen
Die Produktinformationen werden üblicherweise zunächst in Englisch verfasst und anschließend in alle relevanten EU-Sprachen übersetzt. Sie umfassen:
SmPC, PIL und Labeling
auch bekannt als:
- Fachinformation, Zusammenfassung der Merkmale des Arzneimittels, Summary of Product Characteristics (SmPC),
- Packungsbeilage, Gebrauchsinformation, Package Information Leaflet (PIL), Package Leaflet,
- Etikettierung, Etikett(en), Labeling, Text on Inner- and Outer Packaging
Life Cycle Management
Übernahme des Linguistic Reviews mit Member States
- Etablierte Kontakte zu Ansprechpartner der Behörden aller EU-Member States
- Übernahme der gesamten Kommunikation zwischen Behörde und Übersetzer
- Inhaltliche und sprachliche Bearbeitung des Behördenfeedback
- Durch medizinisches und regulatorisches Know-how schnelle Problemlösung bei allen Rückfragen und Finalisierung der Labelings (Formblatt QRD 2)
Wir stehen für höchste Qualität seit über 45 Jahren.
Zulassungsdossier
Vorbereitung und Übersetzungen aller 5 Module des Common Technical Document (CTD)
Die Regelungen für die behördliche Genehmigung von Arzneimitteln sind in Europa weitgehend harmonisiert. Als Basis für die Arzneimittelzulassung am europäischen Markt dient das Common Technical Document (CTD bzw. eCTD).
Es enthält neben administrativen Informationen detaillierte Angaben zur pharmazeutischen Qualität und Herstellung, Wirksamkeit und Unbedenklichkeit des Arzneimittels (Nachweis durch Dokumentation klinischer und nicht-klinischer Studien).
Unser Prozess umfasst alle Schritte zur problemlosen Einreichung sowohl für das ganze Dossier als auch für einzelne Dokumente oder Module.









